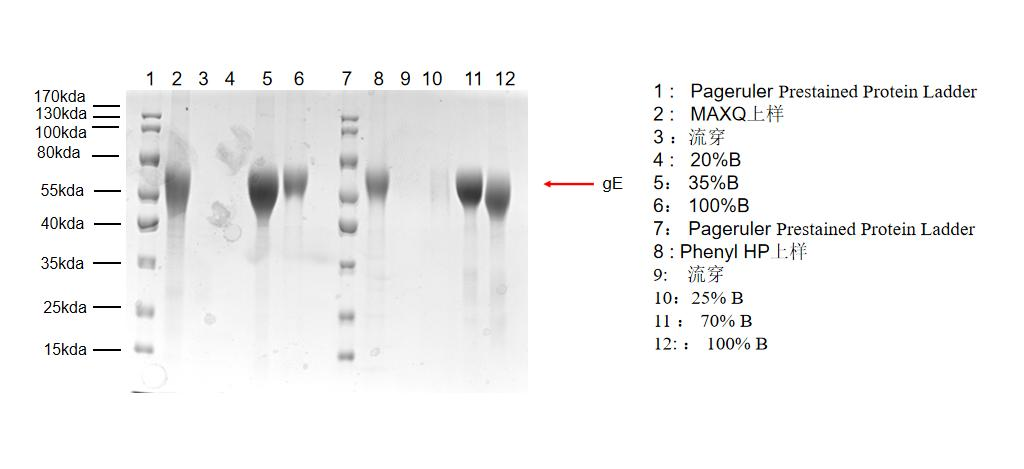
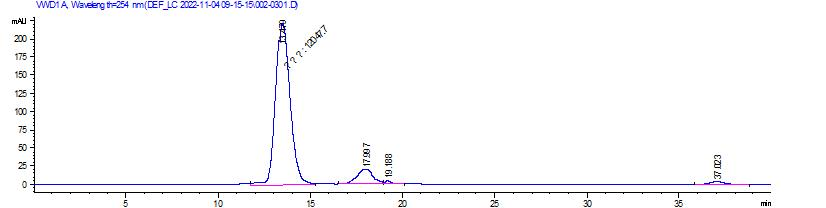
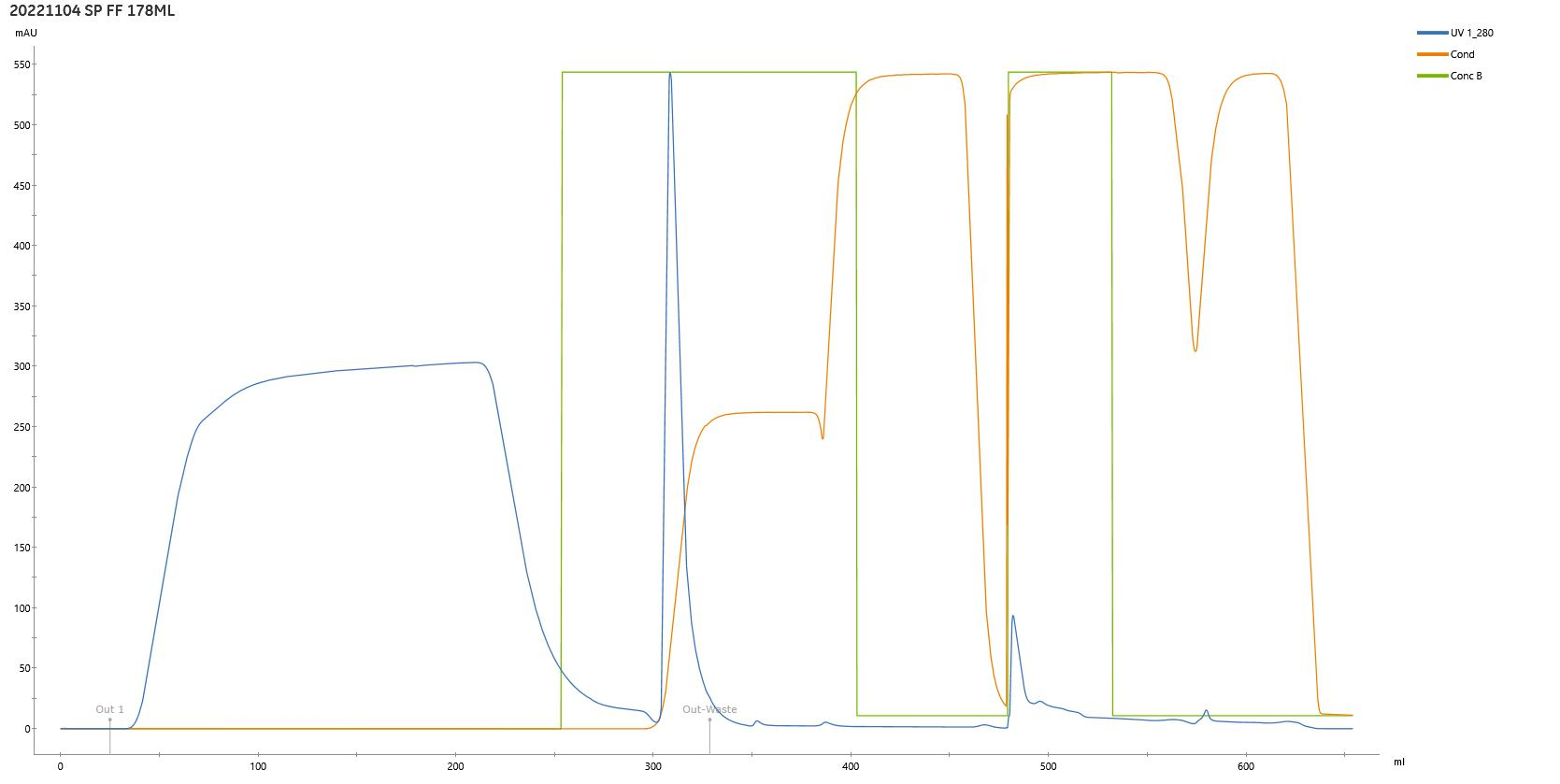
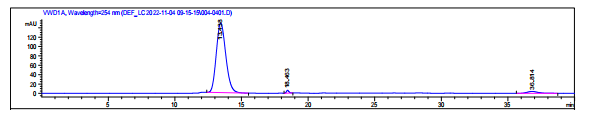
×
生物反应器
细胞培养袋
配套耗材
细胞分选 & 监测
微载体
配液解决方案
储液解决方案
无菌取样
无菌连接&断开
冻存&冻融
分装&传输
管路&配件
层析柱
预装柱
层析系统
凝胶过滤层析
离子交换层析
抗体纯化亲和层析
其他亲和层析
疏水层析
多模式层析
聚合物层析
过滤系统
过滤夹具
滤器
注射用水
缓冲溶液
消泡剂
CytoLinX® RW 一次性摇摆式系统
CytoLinX® BR 一次性罐体式生物反应器
CytoLinX® GB台式玻璃生物反应器
CytoLinX® 完整性测试仪
CytoLinX® 电极套管系列组件
CytoLinX® WB 一次性细胞培养袋
CytoLinX® 一次性使用静置细胞袋
CytoLinX® BRCF一次性下搅拌式生物反应袋
CytoLinX® BRCF 系列一次性下搅拌式微生物反应袋
CytoLinX® BRTF 系列一次性顶搅拌式生物反应袋
BioHub® 系列细胞培养方瓶
BioHub® 系列挡板三角摇瓶
BioHub® 系列三角摇瓶
BioHub® 系列高效摇瓶
BioHub® 系列一次性细胞培养转瓶
BioHub® 系列摇管
BioHub® 系列一次性细胞工厂
BioHub® 系列方形培养基瓶
BioHub® 系列一次性离心管
BioHub® 系列一次性真空过滤杯
BioHub® 系列超低吸附培养板
BioHub® 系列多孔细胞培养板
BioHub® 系列一次性细胞培养皿
BioHub® 系列一次性移液管
BioHub® 系列酶标板及酶标板配件
BioHub® 全自动生物过程分析仪
BioHub® 手动磁分选
Puredex® Cyto-1 微载体
BioHub® DS一次性桌面搅拌系统
BioHub® 桌面式一次性搅拌袋
BioHub® BM一次性磁力搅拌系统
BioHub® 一次性使用搅拌袋
BioHub® UM 敞开式上搅拌系统
BioHub® 一次性使用灌装系统
BioHub® FD 投料系统
BioHub® 一次性粉末投料袋
BioHub® 一次性称量袋
BioHub® 2D储液袋
BioHub® 3D圆型储液袋
BioHub® 3D方型储液袋
NovaLinX® Nuclease-Free 一次性储液袋
BioHub® 一次性储液瓶
BioHub® 储液瓶工具套装
BioHub® 2D储液托盘
BioHub® 2D托盘转运推车
BioHub® 3D圆型塑料支撑桶
BioHub® 3D方形塑料支撑桶
BioHub® 3D方形不锈钢支撑桶
BioHub® 一次性取样袋
BioHub® 一次性针刺取样瓶
BioHub® 无菌水样袋
BioHub® 无菌取样底座
BioHub® 无菌封管机
BioHub® 无菌接管机
BioHub® PVC 无菌接管机
BioHub® 无菌手动断开钳
BioHub®压力监测记录仪
BioHub® 手持式无菌封管机
HemoLinX® CFT 细胞冻存袋
BioHub® 一次性冻融保护袋
BioHub® 塑料冻融盒
BioHub® Fill 一次性分装系统
BioHub® 穿墙系统
BioHub®一次性转接头
BioHub® 一次性卡盘接头
BioHub® 软管堵头
BioHub® 硅胶垫片
BioHub®卡箍&闷盖
BioHub® 一体式隔膜仪表三通
SynaLinX® TST铂金硫化硅胶管
SynaLinX® RST铂金硫化硅胶编织管
SynaLinX® MST 铂金硫化硅胶管
SynaLinX® HST 铂金硫化硅胶管
SynaLinX® PST 铂金硫化硅胶泵管
SynaLinX® B-Flex™ 热塑管
Chrom-LinX® 实验室级别层析空柱
Chrom-LinX® 手动层析柱
Chrom-LinX® 电动层析柱
VERDOT Ips² InPlace™工业级电动层析柱
Chrom-LinX® 6.6实验室级别层析空柱
ChromaX® Geldex® PG系列预装柱
Chrom-Trap® / Chrom-Screen™ 预装柱
ChromaX® A20亲和色谱分析柱
PuriLinX®台式层析系统
Geldex® PG 凝胶过滤填料系列
Chromstar® FF 凝胶过滤填料系列
Puredex® LH-20 凝胶过滤填料
Puredex® G 凝胶过滤填料系列
Chromstar® B 凝胶过滤填料系列
Chromstar® CL 凝胶过滤填料系列
MaXtar® HR XL 离子交换填料系列
MaXtar® HR 离子交换填料系列
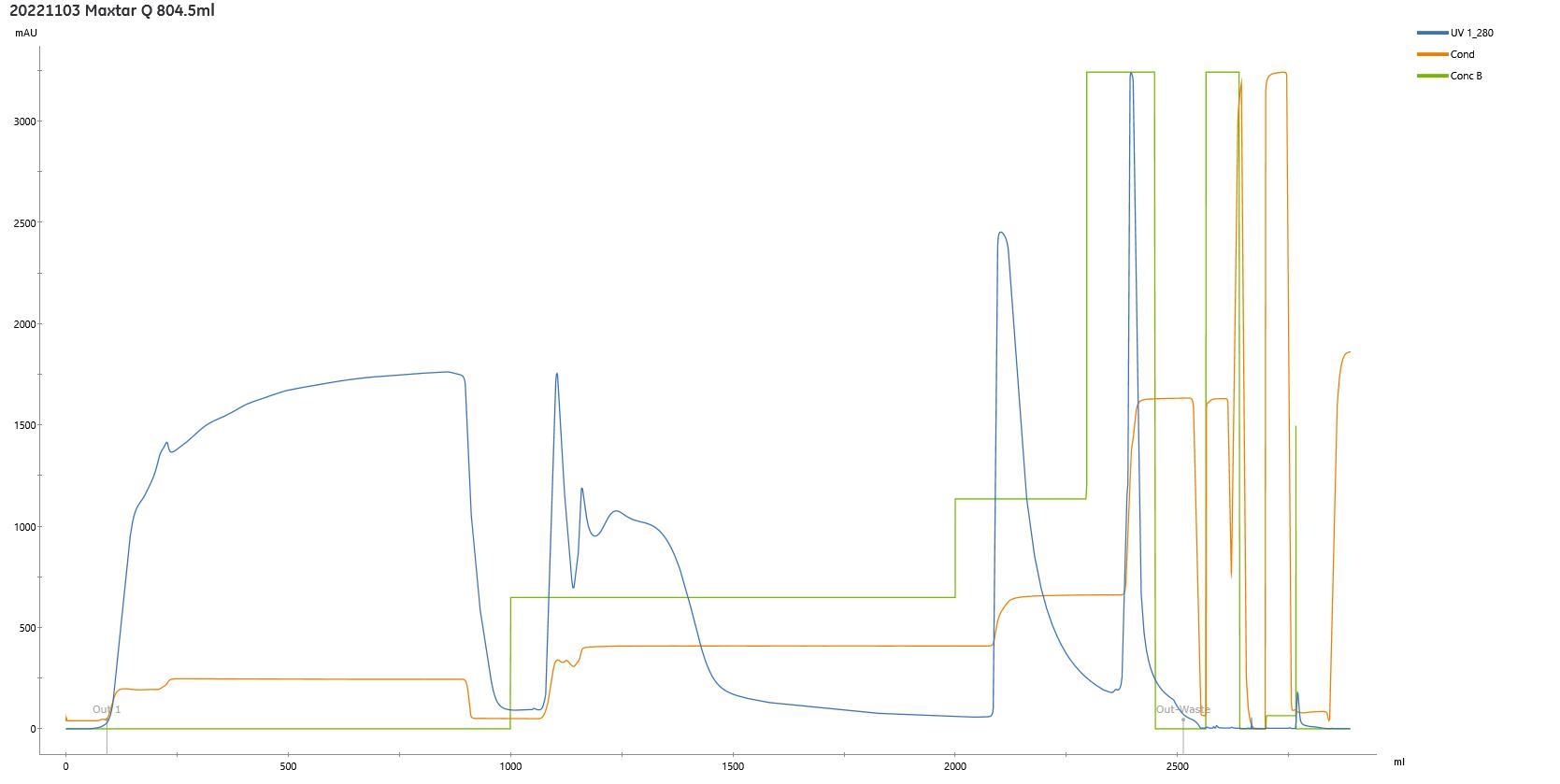
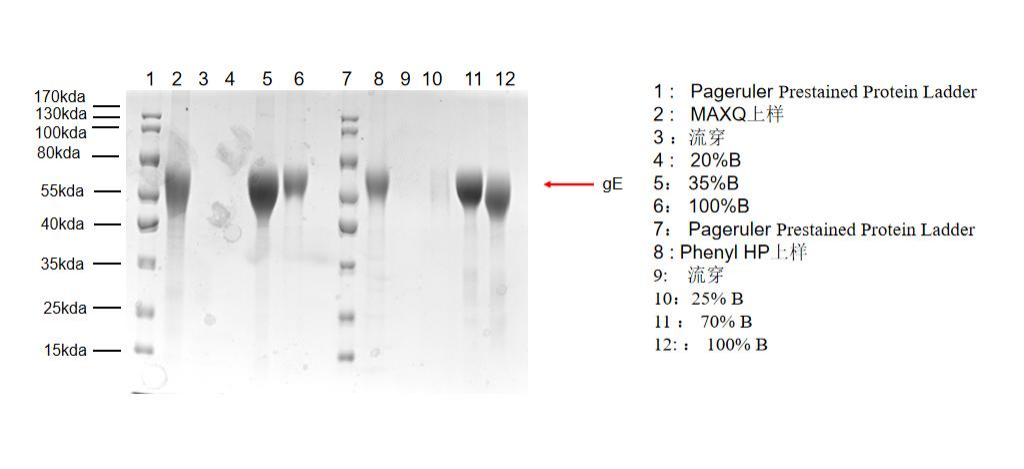
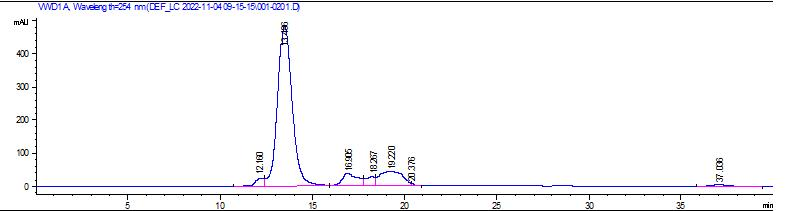
MaXtar® Q离子交换填料系列
Puredex® 离子交换填料系列
Chromstar® XL 离子交换填料系列
Chromstar® HP 离子交换填料系列
Chromstar® FF 离子交换填料系列
Chromstar® BB 离子交换填料系列
MaXtar® InnovA Pro 抗体亲和填料
MaXtar® ARPA 抗体亲和填料
MaXtar® Protein G 抗体亲和填料
MaXtar® rProtein A 抗体亲和填料
Protein G Chromstar® HP 抗体亲和填料
Protein G Chromstar® 4FF 抗体亲和填料
rProtein A Chromstar® FF 抗体亲和填料
ChromaX® MaXtar® MabCap 抗体亲和填料
Ni Chromstar® 亲和填料系列
Benzamidine Chromstar® 4FF 亲和填料系列
Heparin Chromstar® 亲和填料系列
PlasmidCap Chromstar® HP 亲和填料
MaXtar® PlasmidCap HR 亲和填料
Glutathione Chromstar® 亲和填料系列
MaXtar® Chelating 亲和填料
IMAC Chromstar® 亲和填料系列
CNBr Activated Chromstar® 亲和填料系列
NHS Activated Chromstar® 4FF 亲和填料
Blue Chromstar® 亲和填料系列
MaXtar® Blue 亲和填料系列
MaXtar® Heparin 亲和填料
Chelating Chromstar® FF 亲和填料
MaXtar® 疏水填料系列
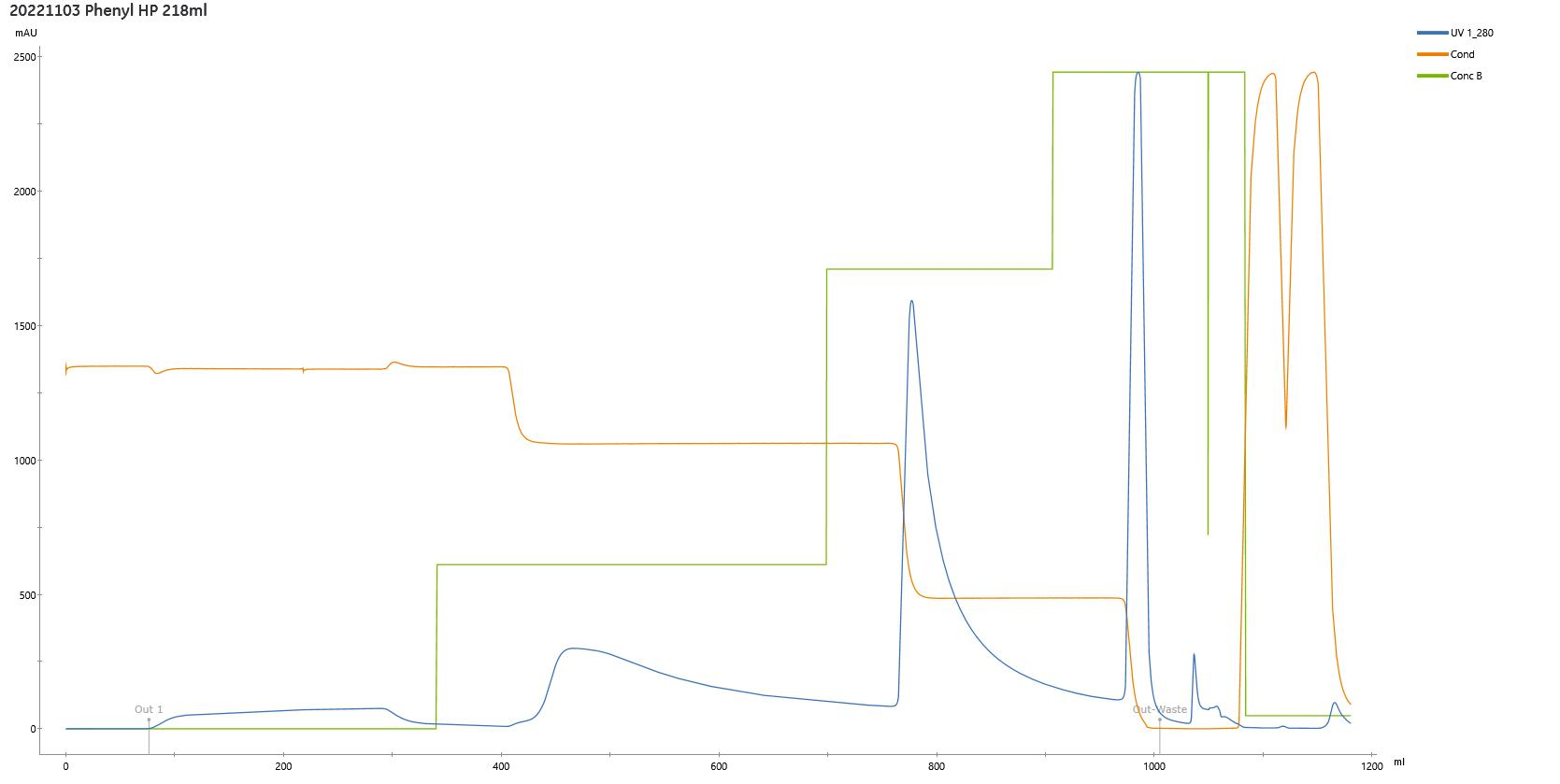
Chromstar® HP 疏水填料系列
Chromstar® FF 疏水填料系列
MaXtar® HR 疏水填料系列
ChromaX™ 羟基磷灰石层析介质
MaXtar® MMC 多模式填料系列
MaXtar® MMA 多模式填料系列
Maxgo® 15/30RPC 反向层析介质
Maxgo® oligo dT (25) pro 亲和介质
Maxgo® 30/50S 离子交层析介质
FiltraLinX® Lab 超滤系统
FiltraLinX® Pilot 超滤系统
FiltraLinX® 桌面手动中空纤维超滤系统
FiltraLinX® 桌面超滤系统
FiltraLinX® 全自动超滤系统
FiltraLinX® 手动超滤系统
FiltraLinX® 半自动超滤系统
FiltraLinX® 桌面手动盒式膜超滤系统
FiltraLinX® 超滤夹具
FiltraLinX® 除病毒过滤夹具
FiltraLinX® P3C 型立式深层过滤夹具
FiltraLinX® M 型卧式深层过滤夹具
Cernolix®系列 KSG 亲水性滤器
VentiLink® 系列 ESG 疏水性滤器
Puruflon®系列FSG 疏水性滤器
HydroLinX® 瓶装注射用水
HydroLinX® 袋装注射用水
HydroLinX® 缓冲溶液
HydroLinX®消泡剂